Публикация
Семейство Филовируси. Кратка вирусологична характеристика на род Ебола- и Марбург вирусите.
Кратки вирусологични данни за строежа на генома, репликационния цикъл и функцията на основните структурни и неструктурни вирусни протеини.
Филовируси
Към семейство филовируси се причисляват вирусът Ебола и вирусът, предизвикващ хеморагияна треска Марбург- МХТ. При естествени обстоятелства тези вируси не се срещат в Европа. Те са отговорни за рзавитието на най-тежката позната на човечеството хеморагична треска –ХТ, характеризираща се с най-неблагоприятна прогноза. Вирусите поразяват хората, висшите примати и някои други човекоподобни маймуни.

- Класификация и основни представители
Към семейство филовируси принадлежат подсемействата Марбург- и Ебола вируси. По отношение на геномния си строеж, те повече наподобяват сем. парамиксовируси, отколкото рабдовирусите. Сходството, между Ебола и Марбург вирусите, е доста ограничено. Щамът Рестън Ебола e изолиран от макаци от Филипините, като по- късно е доказан и при свинете.Щамът Рестън, може да инфектира и хора, но за разлика от щамовете Заир- и Судан, не предизвиква тежко заболяване, дори може да премине и асимптомно, като същевременно стимулира образуването на антивирусни антитела. Предполага се, че естественият гостоприемник на Марбург и Ебола вирусите са полските мишки.
- Строеж на вируса
Вирион

ФИГУРА 1. Електронномикроскопска снимка на вируса Ебола
- Вирионите на представителите от сем. Филовируси притежават неравномерна плеоморфна структура. Те доста наподобяват Рабдовирусите- имат удължена нишковидна структура (lat. Filus- конец, нишка). Те може да са с формата на буквата U, или да имата спираловидна структура. Вирусният партикул притежава среден диаметър от около 80 nm., докато дължината му, показва изключителна вариабилност (до 14 000nm). Марбург вирусът има средна дължина около 665 nm, а Ебола около 805 nm. Вирионът притежава хеликален нуклеокапсид, съставен от вирусните протеини-нуклеопротеиниNP – P(представяни като VP-30 иVP-35) и L (РНК- зависима РНК- полимераза), свързани с вирусната РНК. Нуклеокапсидът е заобиколен от вирусна покривна мембрана, с липидна структура. С вътрешната повърхност на тази мембрана и с участъци от нуклеопротеините, са звързани матриксните протеиниVP- 24 (minor) и VP- 40 (major). С мембраната са свързани и гликопротеините- GP, разположени под формата на тримери и проминиращи около седем нанометра над повърхността на мембраната.
ТАБЛИЦА 1. Основни вирусни протеини и тяхната функционална активност.
| Протеини | Молекулно тегло | Модификация | Функция | |
| Марбург вирус | Ебола вирус | |||
| NP | 96 кДа | 104 кДа | фосфирилиран | Асоцииран с РНК-генома; компонент на нуклеокапсида. |
| VP35 (P) | 32 кДа | 35 кДа | фосфорилиран | Фосфопротеин, компонент на нуклеокапсида; взаимодейства с матриксните протеини; съставна част на транскриптазния комплекс; инхибира синтезата на INF. |
| L | 267 кДа | 267 кДа | РНК-зависима РНК полимераза; компонент на нуклеокапсида. | |
| VP30 | 28 кДа | 30 кДа | фосфорилиран | Компонент на нуклеокапсида; свързан с РНК; |
| VP40 (M) | 38 кДа | 40 кДа | Главен матриксен протеин (М= Major); свързан с вътрешната част на вирусната мембрана и нуклеокапсидните компоненти. | |
| VP24 | 24 кДа | 24 кДа | Малък матриксен протеин (minor); свързан с вътрешната част на вирусната мембрана и нуклеокапсидните компоненти. | |
| GP | 170 кДа | 120/150 кДа | N-гликолизиран
О-гликолизиран |
Повърхностен и мембранен протеин; свързва и неутрализира антивирусните антитела; при Ебола се разцепва от фуринпротеазата на GP-1 (140 kD) и GP- 2 (26 kD). |
| sGP | - | 50 кДа | N-гликолизиран
С-манзилиран |
Секреторен протеинов димер; антиген-примамка ( Decoy- Antigen) за инактивиране на вируснеотрализиращите антитела. |
| Δ-Пептид | - | 6 кДа | О-гликолизиран | 41- аминолиселини дълъг пептид, който се отцепва от фуринпротеазата от карбокситерминалния край на sGP. |
ФИГУРА 2. Модел на Ебола вирус, изобразяващ основните структурни и не структурни протеини всъстава му

- Геном и строеж на генома
- Едноверижният, несегментиран геном на филовирусите е с дължина около 19 000 бази. При Ебола те са 18 957 бази, а при Марбург- вируса съответно 19 099 нуклеотида. РНК-овият геном е с отрицателна полярност. Вирусната РНК не е инфекциозна и от нея не могат директно да бъдат синтезирани вирусни протеини. В 3` и 5` края на генома са разположени некодиращи участъци, чиито терминални базови последователности са комплиментарни една на друга. Предполага се, че те имат подобна функция както Leader- и Trailer- регионите на Парамиксовирусите за инициацията на транскрипцията и образуването на положително полярна РНК в хода на репликацията. Между тези два некодиращи региона са разположени кодиращите секвенции в следната последователност: 3’-NP-VP35/P-VP40/ M-GP-VP30-VP24-L-5`. В обаластта на гликопротеиновия ген е разположена допълнителна нуклеотидна последователност, за която се предполага, че кодира протеин с маса 15 кДа., но до момента такава частица не е индентифицирана. При Ебола вирусът, секвенциите, кодиращи гликопротеиновите молекули за разположени разделено една от друга, с две отделни отворени рамки на разчитане. Синтезът на протеините е зависим от прибавянето на един нуклеотид към иРНК при нейното редактиране. Ако иРНК не бъде редактирана, се транслира в специфичен sGP. В началото и края на всички транскрибирани гени, е разположен високо консервативен пентануклеотид- 3`-UAAUU-5`. Кодиращите участъци са разделени помежду си от къси междугенни нуклеотидни последователности, или се припокриват заимно в къси участъци. Припокриването се ограничава от консервативни транскрипционни сигнали- споменатите вече пентануклеотиди. Такива, взаимно припокриващи се генни краища, са описани за гените на VP- 35 и VP- 40, както и за VP- 30 и VP- 24 в генома на Ебола вируса. В генома на Марбург-вируса, се припокриват само гените, кодиращи протеините VP30 и VP24.
- Вирусни протеини
Функционалната активност на вирусните протеини на Ебола и Марбург вирусите все още не е добре проучена. В доста от случаите се ръководим от факта, че те съответсват на нуклеотидни последователности, кодиращи гени, чиито продукти са с проучена функция и активност, разположени в генните локуси на Парамиксо- и Рабдовирусите.
- 1.Нуклеокапсидни протеини
Нуклеокапсидът на Филовирусите се състои от комплекс от РНК и протеини. Най- разпространен е нуклеопротеинът-NP(96 кДа и 104 кДа за Марбург-, съответно и за Ебола вирусът). Той покрива цялата дължина на РНК-овия геном. Богат е на серинови и треонинови остатъци и би могъл да се приеме като функционален аналог на N-/ NP- протеините при Парамиксо- и Рабдовирусите. Предполага се също, че е отговорен и за хеликалната структура на целия РНК-/NP- комплекс на вириона. VP35 участва като част от РНК-полимеразния комплекс при транскрипционните и репликационни процеци и опосредства свързването на нуклеокапсида с матриксните протеини VP40 иVP30 разположени от вътрешната част на вирусната липидна мембрана. В инфектираната клетка, VP35 се свързва с клетъчния протеин Динеин. По какъв начин това взаимодеиствие повлиява хода на инфекциозния процес, до момента остава неизвестно. Известно е обаче, че VP35 повлиява протичането и патогенезата на заболяването. Той инхибира синтезата на интерферон- алфа от инфектираните клетки.
L- протеинът има активността на РНК- зависима РНК- полимераза. При Марбург вируса, както и при някои от щамовете на Ебола, тои има относително молекулно тегло от около 267 кДа.
Както при рабдо- и парамиксовирусите, и при Филовирусите са описани в състава на нуклеокапсида и други нуклеопротеини- фосфорилираният VP30. РНК- асоциираният VP30 е есенциален за стартирането на синтезата на иРНК по време на транскрипцията на вирусния геном.
- 2.Мембранни протеини
Вирусният гликопротеинGP, е единственият протеин разположен на повърхността на вирусната мембрана, което го прави и единственият, достъпен за имунната система на макроорганизма. Разположен е под формата на хомотример и е силно модифициран със захарни остатъци. Те съставляват около половината от експериментално определената молекулна маса от 170 кДа при Марбург- и съответно125 кДа при Ебола вируса. Захарните групи са свързани както с О-, така и с N-гликозидни остатъци. Сиалова киселина се открива само в състава на гликопротеина на Ебола, но не и на Марбург вируса. Тук тя е заменена от галактозни остатъци. Гликопротеините са прикрепени към карбоксилния край на специфичен аминокиселинен слой в състава на вирусната мембрана. По време на синтезата си в мембраните на ендоплазматичния ретикулум, се постига протеолитично отделяна на специфични сигнални пептиди, разположени в аминотерминалния край на молекулата. Придвижвайки се към клетъчната повърхност, включени във везикули от апарата на Голджи, гликопротеиновите молекули са подложени на протеолитично заделяна от една фуринпротеаза на две части:- екстрамембранна- GP-1 и мембранно свързана- GP- 2. Двете части остават стабилно свързани помежду си, чрез дисулфиден мост. На аминотерминалния край на GP-2 протеина са описани остатъци от хидрофобни аминокиселини, които обуславят способността на гликопротеините за мембранна фузия. Тези домени от молекулата на гликопротеините, които са разположени трансменбранно, са отговорни за хомотримерната структура на гликопротеиновите комплекси. Рамката на четене за синтеза на GP, се използва и за синтеза на един „скъсен” sGP. Отделните белтъчни молекули се свързват помежду си под формата на хомодимери и се експресира от инфектиранита клетки. Неговата синтеза се осъществява, когато иРНК, обуславяща транслацията на гликопротеините, не е претърпяла редактиране. При sGP е доказан специфичен домен в аминотерминалния участък, разположен върху област, включваща около 295 аминикиселини, който е идентичен с GP-1. Карбокситерминалните домени от своя страна са различни. Тук при sGP липсват О- гликолизираните домени , характерни за GP- 1 и трансмембранните домени в карбокситерминалния край на GP- 2. В карбокситерминалния край на sGP, фуринпротеазата отцепва един , съдържащ 40 аминокиселини О- гликолизиран делта- пептид. За sGPсе предполага, че има функция, наподобяваща „антиген- примамка“ ( decoy antigen). Това означава, че той прихваща GP-специфичните неутрализиращи антитеала и възпрепятства тяхното взаимодействие с вириона.
VP40 съответства по своята функция на матриксните протеини на Парамиксо- и Рабдовирусите. Той свързва вътрешната повърхност на вирусната липидна обвивка с нуклеокапсида. GP40 изгражда октамерни комплекси. Той е основният вирусен структурообразуващ белтък.
Като трети белтъчен компонент е описан GP24, който по подобие на предходния гликопротеин също се асоциира с липидната обвивка на вируса.
- 3.Вирусен репликационен цикъл
Репликационният цикъл при всички филовируси е сходен. Филовирусите могат да инфектират голям набор от клетъчни типове, като взаимодействат с широка гама повърхностни клетъчни протеини. Приоритетно е взаимодействието между комплекса GP- 1/GP-2 с ТREM- рецептора (triggeringreceptorexpressedonmyeloidcells) на макрофагите и неутрофилните гранулоцити, с различни лектини от С тип като CD- SIGN, разположен по повърхността на дендритните клетки и макрофагите и L- SIGN, разположен по повърхността на хепатоцитите. Описано е и взаимодействието между филовирусните гликопротеини и цял комплекс други клетъчни рецептори и протеини, като рецептора за фолиева киселина и хепарисулфат- протеогликановте остатъци. Последните изпълняват ролята на рецептори при инфектирането на ендотела и епитела. Инфектирането на ендотелните клетки на кръвоносните съдове е с най- голямо патогенетично значение при вирусните хеморагични трески. Марбург вирусът се свързва и с асиалогликопротеиновия рецептор върху хепатоцитите. Той представлява лектин от С- тип, който свързва свободните галактозни остатъци в състава на N-гликозидните групи, част от повърхностните въглехидратни вериги изграждащи GP. Нормално в състава на GP, въглехидратната компонента завършва със сиалинова киселина, свързана с подлежащи галактозни остатъци. Под действието на една навраминидаза, от терминалните краища на въглехидратната верига се отцепва сиалиновата киселина, което води до „оголване“ на галактозните остатъци. Последните биват разпознати и свързвани от асиалогликопротеиновия рецептор. Вероятно съществуват още доста различни повърхностни молекули, изпълняващи рецепторна функция и опосредстващи инфектирането и на други клетъчни типове. Преминаването на вирусния партикул интрацелуларно, се опосредства от рецепторно-медиирана ендоцитоза. Фузионната активност на GP, опосредства сливането на вирусната и ендозомалната мембрани. Така вирусният нуклеокапсид попада в цитоплазмата на клетката, от където започват същинските процеси по вирусното размножаване. Транскрипцията на генома се катализира от комплекса от протеини- NP, P/VP35 използвайки полиаденилирана иРНК. VP30 е от значение за стартиране на процеса по транскрипция. След това се осъществява и транслацията на иРНК в синтеза на различни вирусни протеини. На края се синтезира преходна иРНК с положителна полярност- „антигеном“, която служи като матрица за репликацията на вирусния геном. Този процес е възможен само когато в цитоплазмата се натрупа достатъчно количество нуклеопротеин. Едновременно с репликацията, в цитоплазмата се осъществява и сглобяването на вирусните нуклеокапсидни компоненти. Този процес се реализира в гранулите на ендоплазматичния ретикулум. VP40 се транспортират до вътрешната повърхност на цитоплазмената клетъчна мембрана с помощта на специфична молекула транспортер- COPII (COPII= coatproteincomplexII). Те се раполагат по повърхността й на местата, където сa прикрепeни тримерните комплекси GP- 1/ GP- 2. Последните след своята синтеза се гликолизират и разделят на два отделни гликопротеина под действието на фуринпротеазата. Гликолизирането е процес на свързване на въглехидратна компонента към белтъчната в състава на гликопротеина. Използваните въглехидратни вериги са клетъчноспецифични и зависят от типа клетка, в която се осъществява гликолизирането. Това е в основата на различните модификации гликопротеини. Инфекциозните вирусни частици напускат клетката гостоприемник чрез пъпкуване на клетъчната мембрана.

ФИГУРА 3. Репликационен цикъл при Ебола.
- Епидемиология
- През 1967 година, трима учени Werner Slenczka, Rudolf Siegert и Dietrich Peters изолират в Марбург Германия вируса Марбург от хора имали контакт с макаци, транспортирани от Уганда. 25 човека от лабораторния персонал развиват клиничната картина на хеморагична треска, седем от които умират. Шест от пациентите предали заболяването на членове от семейството си и болничния персонал. Едновременно инфекцията е била наблюдавана и във Франкфурт и Белград. И при тези случаи болните имали контакт с маймуни, транспортирани от Африка. В следващите години Марбург вирусът бил изолиран и доказан при болни от Западна Африка и в региона около езерото Виктория. В периода 1998-2000 година избухва епидемия от Марбург- хеморагична треска в Дурба- Демократична Република Конго. По време на тази продължителна епидемия, при 154 човека била доказана Марбург- вируса инфекция. 84% от инфектираните загиват. С подобна тежест протича и епидемията от 2005 година в Северна Ангола с 227 смъртни случая.
ТАБЛИЦА 2. Смъртност в проценти при отделните щамове Ебола

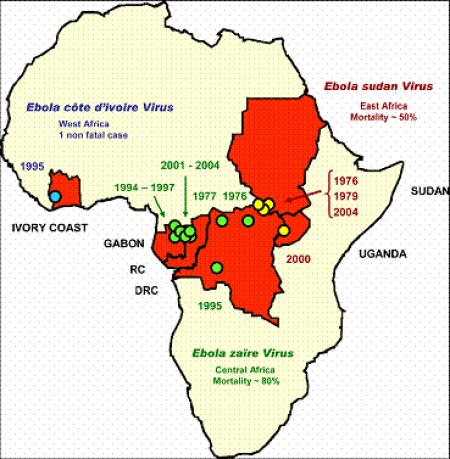
ФИГУРА 4. Карта изобразяваща географските райони на вирусна идентификация.
През 1989 година в Рестън, САЩ, от маймуни внесени от Филипините, беше изолиран щамът Рестън. При приматите той предизвиква протичането на смъртоносна хеморагична треска и може да се предава и на хора. При хора имали контакт с маймуни болни от Рестън-Ебола вирус, се откриват високи титри на антитела срещу този щам, но не е описан случай с разболяване. През 2008 година щамът Рестън беше изолиран и доказан сред прасета във Филипините, които също развиват смъртоносна инфекция. Избухването на епидемии е трудно предотвратимо, поради близкия контакт на прасетата и хората и възможността за зоонотично предаване на инфекцията между самите прасета.
- Предполага се, че определени видове плодоядни прилепи могат да изпълняват функцията на резервоар за Ебола- , а също и за Марбург вируса. В черния дроб и слезката на такива прилепи е доказана вирусна РНК-на щама Заир, а в кръвта на животните се установяват високи титри на антивирусни антитела. Най- вероятно прилепите се заразяват с Ебола, без да развиват заболяване. Човекоподобните маймуни- горили, шимпанзета, и някои висши примати, заразени по естествен път или експериментално, развиват заболяване и умират, особено ако става дума за Марбург- и Заир Ебола вируси. Протичането на инфекцията при маймуните е същото както и при хората. По- голямата част от епидемиите при хората водят началото си от контакт на човек с кръв на заразена маймуна. От инфектирания човек, заболяването се разпространява чрез директен контакт, посредством кръв или други телесни течности, дори и микропръски (капчици на Флюге и Уелс) при говорене. Така заразате се предава на болничния персонал или на членове от семейството. При какви условия вирусите преминават от своя естествен резервоар- прилепите върху маймуните, на този етап е неизвестно. Подобно на някои други вируси, богатата на вирусни частици плацента също се обсъжда като възможен източник.
- • Клиника
- Симптомите при Марбург- и Ебола вирусните хеморагични трески са сходни. Те се проявяват след инкубационен период между 4 и 7 дни и се характеризират с висока температура, изключително силни болки по мускулите и нетърпимо главоболие. Тези първи симптоми бързо се последват от силни болки в гърлото, гадене повръщане, диария и абдоминални оплаквания. Много бързо се манифестират кървенето от конюктивите и други чати на лигавицата на орофаринкса. Кръвоизливите от лигавицата на стомашно- чревния тракт, в белия дроб и устната лигавица, са резултат от отмирането и отпадането на ендотелните клетки на кръвоносните съдове. По време на тази остра фаза и дълго време след това, вирусите могат да се експресират във всички телесни течности: слюнка, урина, семенна течност, вътрекамерната течност на очите. В случай на смъртен изход, вирусната експресия от инфектираните клетки не се преустановява веднага и вирусът продължава да увеличава своето количествоосновно в кръвта. Смъртта настъпва пет, до девет дена след появата на симптомите. Най- често причина за екзитуса са тежки масивни вътрешни кръвоизливи и съпътстващият ги хиповолемичен шок. Също толкова продължително траят и симптомите при пациенти, които преживяват заболяването. При тях се установява отчетливо понижаване на вирусния товар в кръвта, обусловено най- вероятно от образуването на специфични антивирусни антитела. Често по време на реконвалесцентния период, болните се оплакват от появата на ставни симптоми. Те протичат по типа на рективнитеартрити и са имунокомплекснообусловени. Комплексите антиген/антитяло се отлагат вътреставно- по синовиалната мембрана и предизвикват развитието на асептичен възпалителен процес.
- • Патогенеза
- Филовирусите нямат изразен клетъчен тропизъм; те инфектират и унищожават много клетъчни типове от различни тъкани. В ранната фаза на инфекцията, вирусът атакува макрофагите, моноцитите и ендотелните клетки, в които се осъществява първичната му репликация. След кратка първична виремия, вирусът се размножава в ендотелните клетки на кръвоносните съдове, и така на практика инфектира целия организъм. В инфектираните клетки се доказват цитоплазмени включвание, дължащи се на конгломерати, образувани от вирусния нуклеокапсид. Патохистологично се откриват локални некротични лезии в черни дроб и фоликуларни некрози в слезката и лимфните възли. В черния дроб измененията са локализирани основно в синусоидалните пространства, където вирусът атакува преимушествено Купферовите клетки, като съставна част от РХС на организма. В по- късните етапи от заболяването се наблюдават хеморагии в почти всички органи, което се дължи на инфекциозно-обусловеното разрушаване на ендотелните клетки и произлизащата от това загуба на интегритет на стените на кръвоносните съдове. Кръвоизливи в бъбречните тубули е сигурен патоморфологичен белег на тежка бъбречна увреда. Наблюдава се отлагане на фибрин и фибрин-дегенерационни продукти в тубулите. Налице са и тежки смущения в процесите на кръвосъсирване, което в крайна сметка води до развитието на ДИК синдром.
ФИГУРА 5. Патогенетичен цикъл при представителите на сем. Филовируси.
- Инфектирането на моноцитите и макрофагите повлиява отделянето на проинфламаторни цитокини и хемокини- TNF-α, IL- 1β, IFN- ϒ. Те въздействат допълнително върху активацията и хемотаксиса на моноцитите, макрофагите и неутрофилните гранулоцити, водят до вазодилатация и подчертават тежестта на зъзпалението. Често се описва развитието на SLUDGE-syndrome. Той представлява нарушение на микроциркулацията, основаващо се на обратима агрегация на червените кръвни телца, водеща до значимо забавяне на кръвния ток. В резултат се стига до намалена тъканна перфузия и хипокция. SLUDGE-syndrome се развива винаги при хиповолемичен шок. Установено е, че нарушението на съдовия интегритет се повлиява директно и от цитотоксичното действие на вируса. Това се дължи на муцин- подобните домени в състава на GP- 1 протеина. Ако те бъдатотстранени, гликопротеинът губи своето цитотоксично действие invitro.Проведени са експериментални постановки с кръвоносни съдове. При тези опити, в екплантати от човешки кръвоносни съдове, GP- 1 на Рестън Ебола вирусът не показва цитотоксично действие. Доказателството, че GP- 1 е отговорен за цитопатогенния ефект на вируса, е потвърдено експериментално посредством изкуствено създаден мутант: при него една позиция в генома му така е променена, че необходимото за синтеза на GP- 1/GP- 2 РНК- редактиране, се реализира задължително, при което sGP не се образува. Тези мутанти били съществено по- цитотоксични, в сравнение с дивия тип. При sGP липсва муцин- подобен домен. Това се приема като доказателство, че едновременната синтеза на sGP, понижава чувствително цитотоксичността на GP- 1 и на вируса като цяло.
- Комплексът GP-1/GP-2, има и друга функция, повлияваща патогенезата. Свързвайки се с цитоплазмената мембрана на инфектираната клетка, той води до маскиране на различни клетъчни повърхностни протеини: например MHC- клас I и епитопите на други собствени за клетката гликопротеини. Заразената клетка, в следствие на това маскиране, „губи“ своите MHC- клас Iмолекули, при което специфичните анти GP- антитела не могат да я разпознаят.
- Освен директното цитотоксично действие на филовирусите, изразяващо се в увреда на ендотела на кръвоносните съдове, те повлияват в началото на инфекцията и неспецифични имунологични защитни реакции. Фосфопротеинът VP35 ограничава продукцията на клас 1 INF- α и INF- β, инхибирайки фосфорилирането на IRF- 3 (interferonregulatoryfactor- 3). В следствие на това IRF- 3 не се транспортира до клетъчното ядро и не може да упражни своята функция като транскрипционен фактор върху индукцията на експресията на интерфероновия ген.
- Матриксният протеин VP24 от своя страна блокира опосредстваната от интерферона сигнална каскада, в следствие на което се инхибира фосфорилирането на един специфичен протеин-p38- централен фактор при интерфрон зависимата MARK- сигнална система ( mitogen- activated- protein- kinase). По този начин експресията на INF- зависимите гени изостава и клетката не е в състояние да ограничи вирусната репликация, поради смутена интерферонова синтеза. Така се нарушават както неспецифичните, така и специфичните защитни механизми на организма, тъй като интерферонът освен като част от неспецифичната защитна система, поради директният му антивирусен ефект, има огромно значение за активирането на специфичните имунни защитни механизми.
- При животните, есенциалното действие на интерферон- опосредствената защита, може да бъде експериментално доказана: имунокомпетентните възрастни мишки преживяват инфекцията с Ебола. Те умират само, ако предварително са инокулирани с анти-интерферонови антитела. Подобна е и съдбата на мишки, при които гените за рецепторите за интерферон 1 и 2, са делетирани.
- Диагностика и имунитет
- По отношение на антителния отговор, имунитетът все още не е напълно проучен в детайли. Между десетия и четиринадесеттия ден в кръвта на преживели инфекцията се доказват антитела с помоща на ELISA и имунофлуресцентния метод срещу нуклео-, фосфо- и матриксните протеини- ( NP; VP45; VP40), както и срещу гликопротеините- GP-1/GP- 2. Антигликопротеиновите антитела са вируснеутрализиращи. По време на предишни епидемии от Ебола са правени проучвания заразликите в имунитета между пациенти преживели Ебола- инфекцията и такива, завършили с екзитус. Вирусният товар бил доста висок и при двете групи пациенти още съвсем в началото на инфекцията. При групата, завършила летално, вируснят товар в хода на инфекцията се повишил, в сравнение с преживелите инфекцията, при които той останал нисък и впоследствие се негативизирал.
![]()
- По време на реконвалесцентния период в плазмата на пациентите се доказват IgM- и IgG- антитела, появата на които се последва от елиминиране в кръвта на вирусните антигени. През тази фаза се активират и цитотоксичните Т- лимфоцити и свързаната с тях експресия на FasL, Perforin и INF- γ. В ранната фаза на инфекцията, в групата на екзитиралите, в сравнение с тази на преживелите, се описва по- изразено Т- клетъчно активиране и повишено образуване на INF- γ, които въпреки това не успяват да ограничат вирусната инфекция. С напредване на заболяването се засилва и експресията на INF- γ , FasL, и перфорин, както и процесите по апоптоза. Предполага се, че това е следствие на интензивното разрушаване на моноцитите и ендотелните клетки в кръвоносните съдове, като част от генерализираното вирусно разпространение.В следствие на тези проучвания, някои автори приемат центарлната рола ня Т- клетъчния имунитет като основен защитен механизъм в борбата с инфекцията.
- В миналото диагнозате се е постявяла чрез директно изолиране на вируса от серум или други телесни секрети по време на виремията. Марбург- вирусът може да бъде култивиран във VERO- клетъчна култура (изготвена от клетки на маймунски бъбрек), а Ебола се култивира в МА- 104 клетъчна култура ( фетални бъбречни клетки от MacacusRhesus). В днешно време метод на избор е доказването на вирусната РНК в телесни секрети с помоща на PCR- техника. Тъй като рискът от възникване на вътреболнична инфекция сред медицинския персонал във вирусологичните лаборатории и болниците е твърде висок, са въведени сециални мерки за сигурност от трето ниво, за работа с особено опасни инфекции.
- Терапия и профилактика
- До момента медицината не разполага с надеждно лекарство против Марбург- и Ебола вирусите. Все още в стадий на проучване са рекомбинантните технологии по синтезата на вирус- подобни партикули, които да послужат за създаването на ефикасна ваксина. Специфична антивирусна терапия на този етап не е открита: Рибавиринът, като широкоспектърен противовирусен препарат срещу РНК- ови вируси, е бил прилаган без успех. Приложението на човешки имуноглобулин, получен от плазмата на пациенти, преболедували от Ебола, би могъл да се използва при остри форми на заболяването- в началните му стадии. Той води до създаването на пасивно придобит изкуствен имунитет. Това е експериментално потвърдено при опити с животни- мишки. Животните, които преживеят инфекцията, образуват вирус- специфични антитела. Мишките, получили имуноглобулин преди инфектирането с Ебола- вирусът, не развиват клинична картина на хеморагична треска.
![]()
ФИГУРА 6. Превантивни мерки срещу вирусно разпространение.
- Нитензивно лечение
- Пациенти, при които се прдполага ХТ с Ебола вирусна етиология, подлежат на незабавна хоспитализация в отделения за интензивни грижи.
- Лечението е основно патогенетично. То цели поддържането на жизненоважните функции- необходимият водно- електролитен баланс, профилактиране и терапия на острата сърдечно- съдова слабост, повишената пропускливост на белодробните кръвоносни съдове. Показно е вливането на кръвосъсирващи препарати и тромбоцитна маса. При установяване на ДИК, провеждане на незабавно лечение за отстраняването му.





Коментари